当社の着色セルロース微粒子「NanoAct®」を用いたCOVID-19抗原検査キットが米国で発売開始
2020年12月8日
旭化成株式会社
旭化成株式会社(本社:東京都千代田区、社長:小堀 秀毅、以下「当社」)の着色セルロース微粒子「NanoAct®」を用いたAccess Bio社のCOVID-19抗原検査キット「CareStart™ COVID-19 Antigen」(以下「CareStart™ COVID-19 Ag」)が、米国食品医薬局(Food and Drug Administration、以下「FDA」)の緊急使用許可(Emergency Use Authorization、以下「EUA」)を受け、米国での「CareStart™ COVID-19 Ag」販売を開始しましたのでお知らせします。
 「NanoAct®」の製品写真
「NanoAct®」の製品写真 「CareStart™ COVID-19 Ag」の製品写真
「CareStart™ COVID-19 Ag」の製品写真
- 1.「NanoAct®」について
「NanoAct®」は当社のコア技術であるセルロース加工技術によって誕生した、着色セルロースナノ粒子です。主に迅速検査キットの標識粒子として用いられ、インフルエンザ検査キットなどに使用されています。このたび、豊富な発色バリエーションや、陽性判定ラインの発色の良さによりユーザーの視認性が向上することがAccess Bio社により評価され、「CareStart™ COVID-19 Ag」への採用が決まりました。 - 2.COVID-19抗原検査キット「CareStart™ COVID-19 Ag」について
昨今のCOVID-19の感染拡大に伴い、短時間で実施できるスクリーニング検査の重要性が増しています。そのなかでもPCR検査と異なり、特別な検査装置を必要としない迅速検査キット※1の需要が高まっています。現在世界中の診断薬メーカーがコロナ抗原検査キットの開発を行っているなかで、マラリアの迅速検査キットの世界最大手であるAccess Bio社(本社:米国ニュージャージー州、社長:Young H. Choi)が「CareStart™ COVID-19 Ag」を開発しました。
「CareStart™ COVID-19 Ag」は、臨床検体を用いた試験において、RT-PCR※2との陽性一致率88.37%(38/43)、陰性一致率100%(63/63)と同程度の感度が示されたことによりFDAのEUAを受けました。また、通常のPCR検査では1-2日検査に時間を要するところ、本製品では約10分と短時間で検査が可能となります。加えて「NanoAct®」の特長である豊富なカラーバリエーションにより、陽性判定ライン(図中の「T」)が青色、コントロールライン※3(図中の「C」)が赤色と、異なった色で示すことができるため、判定がしやすく、ユーザーフレンドリーな検査キットです。
「CareStart™ COVID-19 Ag」はFDAのEUAのほかに欧州ではCEマーク※4も取得しており、今後欧州や東南アジアやアフリカ諸国でも順次販売が開始される予定です。
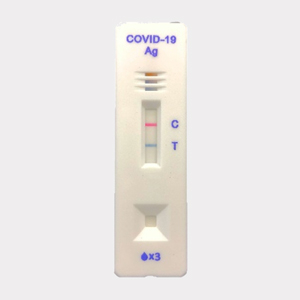 図.陽性検体結果
図.陽性検体結果
- 3.今後の展開
「NanoAct®」を使用したCOVID-19抗原検査ならびに、インフルエンザやそのほか複数の感染症を1つのキットで検出できるマルチ検査キットの開発が米・欧・アジアの診断薬メーカーでも進行しており、今後も「NanoAct®」は多くのキットでの採用が見込まれています。
引き続き、当社の技術を通じて、COVID-19の感染拡大対策に貢献してまいります。
- ※1迅速検査キット抗原抗体反応を使用した簡易迅速診断キット
- ※2RT-PCRポリメラーゼ連鎖反応(PCR)による増幅を経時的に測定することで、増幅率に基づいて鋳型となるDNAの定量を行う測定法
- ※3コントロールライン検査が正常に完了しているかを確認するライン(線が出現した場合は、テストが正常に完了したことを表す)
- ※4CEマーク欧州連合(EU)加盟国の基準を満たすものに付与される基準適合マーク
- ※「NanoAct®」は、旭化成株式会社の登録商標です。
- ※「CareStart™ COVID-19 Ag」は、日本国内では、未承認の体外診断薬用医薬品です。
以上
